ACTIVIDAD N° 10
UNIÓN COVALENTE.
Hola cuarto año!
En la Actividad N° 9 vimos que los átomos se unen con otros átomos para alcanzar la estabilidad, la cual se logra teniendo ocho electrones en su último nivel energético, salvo el Hidrógeno que la alcanzan con dos electrones (Regla del Octeto).
También estudiamos los tres tipos de uniones químicas conocidas: Unión Iónica (cuando se unen átomos metálicos con átomos no metálicos), Unión Covalente (cuando se unen átomos no metálicos) y Unión Metálica (se unen átomos metálicos).
También vimos que en las uniones químicas intervienen los electrones de valencia. Se llama así a los electrones que ocupan el último nivel en la configuración electrónica (el nivel más externo)
En ésta Actividad nos vamos a detener en el ENLACE COVALENTE, debido a que se conocen dos tipos de enlaces covalentes: EL ENLACE COVALENTE COMÚN y el ENLACE COVALENTE DATIVO o COORDINADO.
ENLACE COVALENTE COMÚN:
Es la unión química entre dos átomos en la cual el par de electrones compartidos está formado por un electrón proveniente de cada uno de los átomos entre los que se produce la unión. Ésta unión se puede establecer entre átomos de un mismo elemento o entre átomos de diferente elemento pero SIEMPRE con característica NO METÁLICA.
Por otra parte, y de acuerdo a la cantidad de electrones necesarios para alcanzar la estabilidad, los átomos pueden compartir uno o más pares de electrones, dando lugar a UNIONES COVALENTES SIMPLES, DOBLES O TRIPLES.
La Unión Covalente Simple se produce cuando los átomos tienen UN PAR de electrones compartidos, aportando cada uno, un electrón del par.
Por ejemplo: La molécula de Cloro está formada por dos átomos. Como el Cloro tiene 7 electrones de valencia necesita obtener 1 electrón del otro átomo para alcanzar la estabilidad. El Diagrama de Lewis para ésa unión será:
La Unión Covalente Doble se produce cuando los átomos tienen DOS PARES de electrones compartidos, aportando cada uno, DOS electrones.
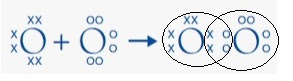
Por ejemplo: La molécula de Oxígeno esta formada por dos átomos. Como el Oxígeno tiene 6 electrones de valencia necesita obtener 2 del otro átomo para llegar a 8 y alcanzar la estabilidad. El Diagrama de Lewis será:
Ejemplo: La molécula de Nitrógeno esta formada por dos átomos. Como el Nitrógeno tiene 5 electrones de valencia necesita obtener 3 electrones del otro átomo para llegar a los 8 alcanzando la estabilidad. El Diagrama de Lewis sera:
Por ejemplo: O2S tendremos 2 átomos de Oxígeno que se unen a 1 átomo de Azufre. Tanto el Oxígeno como el Azufre son NO METALES y poseen 6 electrones de valencia, por lo tanto tendremos una Unión Covalente. El Diagrama de Lewis es
N°
|
Fórmula |
Característica |
Característica
|
Tipo de
Unión |
|
1 |
Br2O3 |
|||
|
|
Cu2O |
|||
|
3 |
FeO |
|||
|
4 |
Cl2O5 |
|||
|
5 |
HF |
|||
|
6 |
NaH |
|||
|
|
Al2O3 |
|||
|
8 |
HgO |
|||
|
9 |
SnO2 |
|||
|
10 |
CdO |
|||
|
11 |
Li2O |
|||
|
12 |
SnCu |
|||
|
|
MoO2 |
|||
|
14 |
N2O5 |
|||
|
15 |
NiMo |
|||
|
16 |
Ag2O |
|||
|
17 |
CO |
|||
|
18 |
B2O3 |
|||
|
19 |
As2O3 |
|||
|
|
Cs2O |
|||
|
21 |
AuCu |
|||
|
22 |
AgSn |
|||
|
23 |
Au2O3 |
|||
|
|
Cl2O7 |
|||
|
25 |
SnO2 |
|||
|
26 |
CH4 |
|||
|
27 |
BrH |
|||
|
28 |
KH |
|||
|
29 |
Ni2O3 |
|
|
|
|
|
PbO |
|
|
|








Comentarios
Publicar un comentario